Een mRNA-gebaseerd vaccin zou het immuunsysteem kunnen helpen kanker te bestrijden
Hendel
Slechte wetenschappers
Als de onderzoeken worden bevestigd, openen zich twee complementaire horizonten: het gebruik van reeds goedgekeurde vaccins als goedkope aanvullingen op immunotherapie en de ontwikkeling van universele vaccins die zijn ontworpen om de immuunstimulatie te maximaliseren in de aanwezigheid van tumoren.
Over hetzelfde onderwerp:
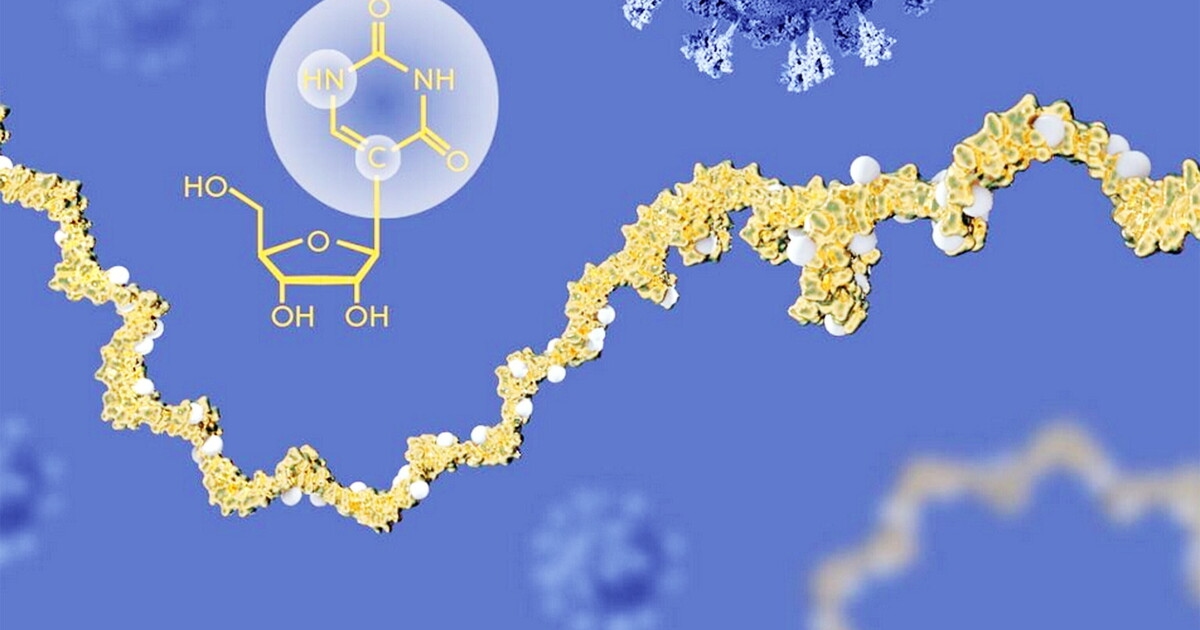
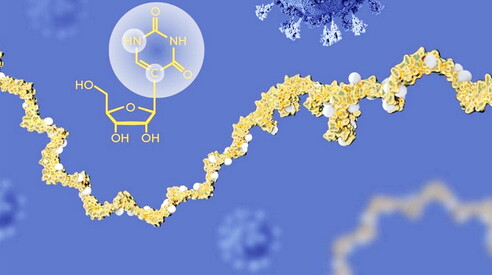
mRNA-vaccins, ontwikkeld ter bestrijding van SARS-CoV-2, laten een onverwacht effect zien dat, indien bevestigd, van groot klinisch belang is: ze lijken de antitumorrespons te versterken bij patiënten die met immunotherapie worden behandeld. De gegevens, gepresenteerd op het jaarlijkse congres van de European Society for Medical Oncology in Berlijn en besproken in Science , tonen aan dat kankerpatiënten die met immunotherapie werden behandeld en een mRNA-vaccin kregen – zelfs een vaccin dat niet gericht was tegen tumorantigenen – significant langer leefden dan degenen die het niet kregen voordat ze met immunotherapie begonnen.
Een team van het MD Anderson Cancer Center in Houston, onder leiding van Steven Lin en met een presentatie van Adam Grippin, analyseerde retrospectief de medische dossiers van meer dan duizend patiënten met gevorderde huid- en longkanker die tussen 2019 en 2023 werden behandeld met immuuncheckpointremmers, medicijnen die de fysiologische remmen van het immuunsysteem verwijderen, waardoor het tumorcellen kan herkennen en aanvallen. Ze ontdekten dat patiënten die binnen 100 dagen na aanvang van de immunotherapie een COVID-19 mRNA-vaccin kregen, een mediane overleving hadden die bijna twee keer zo lang was als die van niet-gevaccineerde patiënten: 37,3 maanden versus 20,6 maanden voor patiënten met gevorderde longkanker. De auteurs bevestigden dat dit fenomeen niet simpelweg te wijten was aan de vaccinatie: patiënten die andere vaccins kregen, zoals griep- of pneumokokkenvaccins – allemaal gebaseerd op eiwitten of polysachariden, niet op mRNA – zagen geen vergelijkbare verbetering. Dit suggereert dat het werkingsmechanisme specifiek is voor het mRNA-platform.
De bevindingen maken deel uit van een onderzoekslijn die dezelfde groep enkele maanden eerder was gestart met werk aan muismodellen, gepubliceerd in juli 2025. In deze studie versterkte een generiek mRNA-vaccin, niet gericht tegen een specifiek tumorantigeen, de werkzaamheid van checkpointremmers in refractaire tumoren. In dat geval was het eiwit dat door het mRNA werd gecodeerd irrelevant: de sleutelfactor was het mRNA zelf, dat fungeert als een stimulator van de aangeboren immuniteit en in staat is ontstekings- en cytokinepaden te activeren die het hele immuunsysteem in hoge staat van paraatheid brengen. De hypothese is dat het mRNA, eenmaal in het lichaam geïntroduceerd, fungeert als een soort gevaarsignaal voor aangeboren immuuncellen en de productie van type I-interferonen induceert, dezelfde moleculen die verantwoordelijk zijn voor de meest intense symptomen na vaccinatie. Deze interferonen activeren dendritische cellen en T-lymfocyten in tumoren en stimuleren hun migratie naar de lymfeklieren, waar immuuntraining plaatsvindt, wat leidt tot de herkenning en vernietiging van tumorcellen door nieuwe T-cellen.
Tumoren reageren op deze aanval door de PD-L1-receptor tot expressie te brengen, die T-lymfocyten remt en aan vernietiging ontkomt. Checkpointremmers, zoals antilichamen tegen PD-1 of PD-L1, blokkeren dit mechanisme en zorgen ervoor dat de immuunrespons actief blijft. In deze context versterkt de stimulatie die wordt gegenereerd door het mRNA-vaccin de effectiviteit van deze therapieën, waardoor er een groter aantal reeds geactiveerde T-lymfocyten ontstaat en het voor de tumor moeilijker wordt om zijn afweersysteem te reorganiseren. Volgens verschillende onafhankelijke experts zijn de resultaten, ondanks het retrospectieve karakter van de analyse, van groot belang en tonen ze een sterk verband aan tussen mRNA-vaccinatie en overleving; het blijft echter noodzakelijk om het effect te verifiëren in prospectieve, gerandomiseerde studies, die de groep van Lin al aan het plannen is.
De betekenis van deze observatie reikt verder dan het specifieke geval van COVID-19-vaccins: het suggereert dat elk mRNA-gebaseerd vaccin, zelfs als het codeert voor een tumor-irrelevant eiwit, de immunotherapie kan versterken door te fungeren als een intrinsieke adjuvans die het immuunsysteem weer wakker kan maken en het kan predisponeren voor een krachtigere reactie tegen kanker. Indien bevestigd, opent dit twee complementaire mogelijkheden: het gebruik van reeds goedgekeurde mRNA-vaccins als goedkope adjuvantia voor immunotherapie en de ontwikkeling van universele mRNA-vaccins die niet zijn ontworpen om zich op één enkel antigeen te richten, maar om de immuunstimulatie te maximaliseren in aanwezigheid van tumoren. Voorzichtigheid blijft echter geboden. De in Berlijn gepresenteerde gegevens zijn nog niet gepubliceerd in peer-reviewed vorm en zijn afkomstig van een retrospectieve analyse, die inherent gevoelig is voor selectiebias en timingfouten. Onsterfelijke tijdbias komt veel voor in dit soort onderzoek: als vaccinatie wordt gedefinieerd als plaatsvindend binnen een bepaald tijdsbestek na aanvang van de therapie, moeten patiënten in die categorie lang genoeg hebben overleefd om de behandeling te ondergaan, wat een schijnbaar voordeel kan opleveren ten opzichte van niet-gevaccineerden. Klinische factoren die niet volledig onder controle kunnen worden gehouden, zoals functionele status, ziektelast, de aanwezigheid van hersenmetastasen, gelijktijdig gebruik van corticosteroïden of antibiotica, of verschillen in toegang tot zorg tijdens de verschillende fasen van de pandemie, kunnen ook vooroordelen veroorzaken die achteraf niet kunnen worden geëlimineerd.
De literatuur over de effecten van vaccinaties bij patiënten die immunotherapie ondergaan, is weliswaar rijk aan positieve rapporten, maar kampt vaak met dezelfde methodologische beperkingen. Diverse observationele studies, waaronder die naar griepvaccinaties, hebben een verbeterde overleving of verminderde toxiciteit gedocumenteerd zonder duidelijk mechanistisch bewijs. In veel gevallen verklaart de zogenaamde 'healthy vaccin bias' – de neiging van patiënten in betere conditie om gevaccineerd te worden – een deel van de resultaten. Het is daarom cruciaal om in prospectieve, gecontroleerde studies, gepubliceerd in tijdschriften en niet aangekondigd op een congres, te verifiëren of het veronderstelde effect daadwerkelijk bestaat en of het reproduceerbaar is over verschillende tumortypen. Alleen een directe mechanistische analyse, gebaseerd op seriële weefsel- en bloedafname, kan verduidelijken of mRNA-vaccinatie daadwerkelijk een meetbare interferonrespons induceert, een toename van lymfocytair infiltraat in tumoren, of een verandering in de expressieprofielen van PD-L1 en andere immuunregulerende moleculen.
Zelfs de preklinische component, hoewel veelbelovend, behoeft bevestiging: muismodellen tonen aan dat mRNA kan werken als een krachtig adjuvans, maar de overgang naar de mens kent verschillen in omvang en immunologische context die moeilijk te voorspellen zijn. Het kan niet worden uitgesloten dat het waargenomen effect gedeeltelijk, tijdelijk of afhankelijk is van specifieke combinaties van therapie en vaccinatietiming. Daarom moeten we geduld hebben: de weg ligt open, maar er is nog een lange weg te gaan voordat we alle factoren kunnen uitsluiten die leiden tot valspositieve resultaten in dit soort vakgebieden.
Meer over deze onderwerpen:
ilmanifesto





